
巩义市仁源水处理材料厂
联系人:孙经理
手机:15838253283(微信同号)
电话:0371-66557686
邮箱:1813885391@qq.com
地址:河南省巩义市工业园区
纤维束填料1米厂家有机污染物胞外作用机理及微生物群体感应调控特征
纤维束填料1米生产厂家有机污染物胞外作用机理及微生物群体感应调控特征。有机污染物(芳香烃、药物、农药等)存在于自然系统(湖泊、海洋、地下水、土壤等)和废水处理系统中,其分子结构复杂、种类多变、溶解性差异大、毒性高并且难生物降解,如何有效将其去除是目前研究的难点。
微生物技术是处理有机污染物的主要手段之一,其中偶合功能材料、降解菌的微生物工艺(如厌氧-好氧法、电催化微生物法)是目前研究热点,但其存在不能完全矿化、易形成复杂或有毒代谢副产物、无法有效控制代谢过程、多种污染物共存时降解效率低等问题。
微生物胞外聚合物(Extracellular polymer subst-ance,EPS)是多糖、蛋白质、腐殖酸、核酸、脂质等生物大分子组成的复杂高分子聚合物,也是微生物识别、吸附和去除有机污染物的重要屏障,其具有亲疏水性、带电性、吸附性、生物降解性及氧化还原性等特性。
目前,已有研究多集中在EPS提取测定方法的改进、官能团组成和性质,及其对有机污染物的去除和作用机理研究。其中作用机理主要涉及物理作用(吸附)、化学作用(还原)和生物降解(生物酶解),而在分子水平的有机污染物去除调控机理方面仍缺少系统性研究报道。
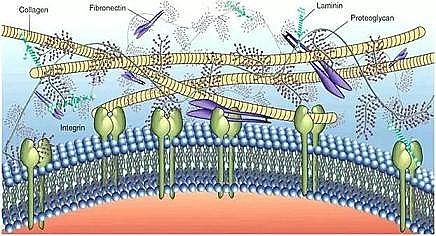
EPS合成及有机物降解均受信号分子和群体感应调控,是强化污染物去除的重要环节。通过外界因素调控EPS去除有机污染物的关键是识别出EPS与有机污染物作用的关键组分。
EPS分子具有复杂多变的网络状空间结构,化合物受体蛋白(识别有机污染物)、跨膜蛋白(运输有机污染物)及其群体感应识别系统贯穿其中,但微生物如何进行污染物识别、分子群体感应调控降解方面的系统性报道不多。
对此,笔者综述了微生物聚集体中EPS对不同有机物的去除作用、群体感应调控机理及其与微生物群落结构的关系,以期对生物强化去除有机物提供指导。
01
胞外聚合物(EPS)的组成和性质
EPS由多糖(PS,40%~95%)、蛋白质(PN,1%~60%)、腐殖质(HS)、核酸(1%~10%)、脂质(1%~10%)等大分子物质组成(均以质量分数计)。
胞外PS由多种同聚糖(如葡聚糖、果聚糖等)和异聚糖(藻酸盐、鞘氨醇胶等)组成。胞外PN含胞外酶和结构蛋白,其中结构蛋白包括细胞表面相关蛋白和碳水化合物-结合蛋白。
此外,EPS中的PN和PS还会以糖缀合物(糖肽、糖蛋白、糖脂等)的形式存在。HS由腐殖酸(HA)、富里酸(FA)和腐黑质组成。
EPS中含碳物质比含氮物质合成更新速度更快,如含氧烷基物质 > 含酰胺基物质 > 含α碳物质 > 含脂肪族碳物质,即多糖 > 蛋白质 > 腐殖质或脂质类。
根据EPS与细胞表面的连接程度及提取方法,其外层到内层可分为可溶型EPS(SOL-EPS)、松散结合型EPS(LB-EPS)及紧密结合型EPS(TB-EPS);根据是否形成水凝胶,EPS分为水凝胶EPS和非水凝胶EPS。
其中,水凝胶EPS又称结构EPS(Structural EPS,SEPS),其有机组成和离子特征决定了污泥性质。EPS具有亲疏水性、带电性、吸附性、生物降解性及氧化还原性等特性。该特性决定了污水处理出水质量、污染物降解程度、活性污泥的沉降和脱水性能等。
02
EPS是难降解有机物进入微生物细胞的重要屏障
胞外多聚物是外源有机物进入细胞和细胞间相互作用的重要通道,具有吸附有机物、持有降解底物的多种酶系、细胞间信号传导、抵抗外源毒物、通过自身水解提供营养物质和有机质等重要功能。
2.1有机污染物的胞内外吸附降解作用
根据有机污染物在细胞吸附降解的位置,有机污染物去除可分为三种方式:
(1)胞外处理,即EPS拦截有机物,胞外酶在胞外直接吸附或降解有机污染物生成代谢物/副产品。如烟曲霉(Aspergillusfumigatus)在去除蒽时主要作用就是胞外酶(木质素过氧化物酶)代谢。
(2)沿程处理,即有机污染物在细胞膜EPS层吸附,同时在胞外酶、周质酶、胞质酶作用下沿程降解。如微生物去除石油烃过程中,其周质酶、胞质酶和胞外酶都参与生物降解,只是不同底物的酶活性不同。
(3)胞内处理,即污染物进入胞内,由胞内酶代谢后排出。如白腐真菌Trametes hirsuta可吸收布洛芬、吲哚美辛、酮洛芬和萘普生,由胞内酶(细胞色素c、P450等)将其代谢后排出细胞。
值得注意的是,毒性物质或生物大分子(如外源DNA抗性基因)可修饰后穿透EPS和细胞膜,比如环境系统中取代芳香族污染物可协助抗生素抗性基因(ARG)绕开细胞外核酸内切酶对于外源ARGs的降解,穿透EPS可渗透屏障进入细胞,促进ARG在细胞间传播。即当EPS不能有效拦截有机污染物时,会存在细胞毒性风险。
此外,外界环境条件变化时,微生物可将胞内处理有机物模式调节为胞外处理。如Yanxia Zhu等发现环境中高浓度CO2可促进钝顶节旋藻(Arthrospira platensis)胞外EPS含量提升,增强EPS吸附苯酚量,致使跨膜扩散(被动运输)进入细胞的苯酚量下降,同时胞外酚羟化酶活性升高112.7%,最终苯酚降解由胞内转移至胞外。
2.2有机污染物代谢的多重诱导调控作用
微生物细胞可感知化学物质、pH、渗透压、温度和氧化还原电势等外界环境因素及其梯度变化。有机污染物通过结合胞外化合物受体蛋白、跨膜蛋白,诱导调控趋化、跨膜运输和微生物胞外EPS合成(生物表面活性剂、胞外多糖)、有机物降解酶基因转录表达,促进有机污染物吸附降解。
(1)趋化。是指细菌适应化学物质浓度梯度做出运动改变,即化学效应分子与细胞膜表面的化学受体蛋白专一性结合,经趋化信号传导,细菌呈现趋向高浓度的正向运动或低浓度的负向运动。化学趋化受体蛋白在细菌和古菌中保守存在,具有特异性和膜拓扑结构。其趋化特征为:
a. 底物诱导。外源有机污染物、次级代谢产物和信号分子均可诱导化学趋化。很多细菌只对可降解底物具有趋化性,如假单胞菌Pseudomonas sp. JHN只对能代谢的4-氯-2-硝基酚具有趋化性,对不能代谢的底物没有趋化性。多氯联苯降解菌Pseudomonas sp. B4经中间代谢产物联苯或苯甲酸诱导培养后,对苯甲酸和4-氯代苯甲酸具有趋化作用。
b. EPS合成或鞭毛控制。细菌趋化运动方向由鞭毛控制;相反,当其需要减少运动时,则强化合成EPS加速在载体表面的粘附。该趋化过程通常由不同的化学感应途径(chemosensory path-way)完成,如粘球菌Myxococcus xanthus通过Dif途径控制细胞外多糖的产生和脂质的趋化性。水稻细菌性谷枯病菌(Burkholderia glumae)的QS(群体感应)基因qsmR可调控鞭毛方向基因的表达。霍乱弧菌(Vibrio cholerae)的CAI-1群体感应系统受菌群趋化Ⅲ类蛋白簇表达控制,其不同生长期的细胞形态、EPS和运动受c-di-GMP(环二鸟苷酸)转录调控。
c. 促进生物利用和降解。细菌通过正向化学趋化过程促进对高疏水性和低底物利用性有机污染物的降解。比较恶臭假单胞菌G7的趋化性和非趋化性菌株发现,有机污染物在非水相液体(NAPL)中时,趋化会增加萘的降解和生物利用度。
d. 双向性(Biphasic chemotaxis)。细菌随外界环境中有机污染物浓度变化呈正向或负向运动。如吲哚浓度 < 1 mmol/L时大肠杆菌E. coli仅负向驱动(驱避剂反应),吲哚浓度≥1 mmol/L时其由负向到正向驱动(吸引剂反应)的时间依赖性反转。
(2)跨膜运输。跨膜蛋白是贯穿整个磷脂双层的内在膜蛋白,其两端分别暴露于细胞膜的外部和内部,在细胞与环境之间交换物质、能量和信息。许多微生物在降解难溶性有机污染物时会由QS诱导产生不同的乳化剂和表面活性剂(如糖脂、脂肽、离子脂质、中性脂质和聚合生物表面活性剂),其中表面活性剂也可降低乳液表面张力起乳化作用,改善细菌运动性和跨膜蛋白表达。
细胞跨膜蛋白在微生物对PAHs(多环芳烃)转运过程中的作用至关重要,其原因在于典型的跨膜蛋白内部主要由疏水性β-折叠组成,两亲性α-螺旋主要分布在其外围,α- 螺旋可促进表面活性剂聚集和细胞膜的磷脂双层融合形成混合的胶束,改变细胞膜的三级结构和构象,而β-折叠促进了表面活性剂插入磷脂双层,以加速PAHs向细胞内部转运,增强细菌与生物膜对污染物的利用率与降解潜能。
(3)转录调控。转录调控是调控细菌基因表达以适应不断变化环境条件的基本机制之一。在自然界中,变构转录因子aTF(allosteric transcription factor)可识别抗生素、一级或二级代谢产物、群体感应信号分子或外源有机污染物。与细菌的经典分解代谢操纵子相反,大多数控制外源有机物生物利用的蛋白以转录激活因子的形式出现(CatM除外,它是一种抑制因子),如萘降解是受单一蛋白质NahR控制的。除了转录因子(TFs)介导,基因转录还受细胞生理状况决定的全局调控因子调节。
03
EPS与有机污染物间的作用机理
EPS去除有机污染物机理包括物理作用(吸附及分配)、化学作用(还原及电化学还原)和生物作用(胞外酶降解)。已报道的有机污染物主要集中在芳香烃(芘、菲)、染料〔甲苯胺蓝(TB)、碱性蓝54(BB54)和抗生素(磺胺类抗生素、四环素)、三氯生等。
部分代表性污染物及其EPS去除机制及检测手段见表 1。
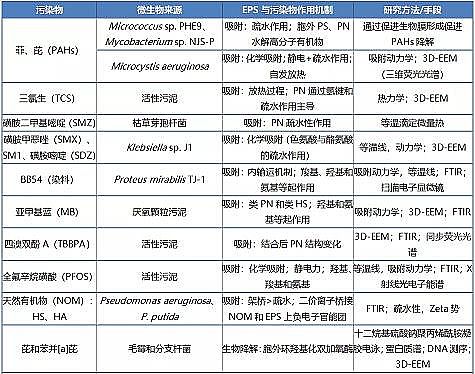
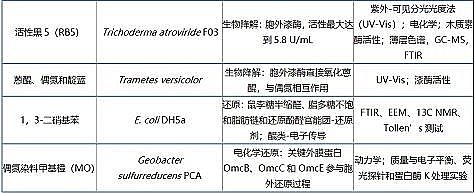
表 1 EPS去除有机物机制及检测手段
3.1EPS与有机污染物之间的物理作用(分配/吸附作用)
(1)分配作用。指水或废水中有机污染物溶入EPS生物大分子中的分配过程。该吸附可逆,与表面吸附位无关,只与温度或有机物溶解度有关。如EPS中糖脂(由无色菌PS1、芽孢杆菌SLDB1、铜绿假单胞菌S5产生)、脂肽(由苍白杆菌产生)作为表面活性剂可以强化PAHs的增溶作用,促进PAHs向微生物细胞的传质。由葡萄糖和半乳糖组成的胞外多糖具有生物乳化活性(由阴沟肠杆菌TU释放),可提高正十六烷生物利用度,促进其降解。
(2)吸附作用。微生物EPS带有大量电荷、极性基团和疏水区域,为有机微污染物提供大量活性吸附位点,其涉及氢键、范德华力、静电相互作用和疏水相互作用4种吸附作用力。
a. 疏水相互作用。疏水作用是疏水物质(疏水官能团)之间存在疏水引力,有报导称其是由吸附在疏水物质表面的气体(水蒸气或溶解性气体)相互联通形成的纳米气泡桥引起。胞外PN中色氨酸和酪氨酸是具有强疏水侧链的疏水氨基酸(含芳香环),可提供疏水吸附位点,通过氢键(含氨基、羟基)和疏水作用吸附污染物;HS含带负电的羧酸基、酚酸基和疏水区域的碳骨架,可通过疏水作用结合污染物。目标污染物的结构差异可导致污染物在EPS上具不同的亲和力和吸附效率。如EPS中的色氨酸、酪氨酸与磺酰胺类可通过疏水相互作用结合形成EPS-磺酰胺复合物,磺胺甲恶唑(SMX)侧基空间位阻小,易占据更多吸附位,EPS吸附效率高,而磺胺嘧啶(SDZ)疏水作用差,不易接近EPS吸附位点,因此吸附效率低。
b. 静电作用。静电作用是带正电的有机污染物与带负电的EPS之间发生反应的有效机制。静电作用受pH和离子强度的影响,并与EPS离子化官能团(如羧基、磷酸基团、巯基和酚酸官能团)的含量和污染物带电性有关。如甲苯胺蓝(TB)可通过静电作用吸附到EPS离子化官能团上,且pH为11.0时污泥EPS对TB的结合力大于pH为7.0时。这是因为当pH为7.0时,仅羧基和磷酸基团被电离;pH为11.0时,羧基、磷酸基、巯基、酚酸基团大部分都被电离,且EPS分子在此pH下可水解断裂糖蛋白中二硫键,增加带电官能团。
c. 氢键。氢键是电负性大、半径小的原子(如O、N、F)之间以H原子为媒介形成类似价键的结构,具方向性、可逆性和加和性。污染物与EPS之间可通过氢键结合,如四环素与好氧颗粒污泥EPS的蛋白质和腐殖酸可通过氢键和范德华力形成复合物。
通常EPS与污染物之间多种相互作用同时存在,而且随外界条件(pH、离子强度、官能团种类和结构)变化其作用机制也发生变化。EPS强疏水性、吸附位点多及吸附力强使其去除率更高。EPS与有机物之间的吸附结合机理具有相似性和差异性,如何找出这些差异的来源从而通过控制EPS与有机物作用的关键组分的生成来实现提升EPS去除有机物的效率是问题的关键。
3.2EPS与有机污染物之间的化学作用(还原及电化学还原)
EPS具有PS的半缩醛还原结构,还原蛋白(细胞色素c、铁氧化蛋白),HS的醌、氮和硫等具有氧化还原活性或电子传导性的成分。多种细菌EPS可以还原硝基芳烃(NAC)、卤代烃和偶氮染料等含强吸电子官能团(如硝基、卤代基)的有机污染物。
(1)电化学活性菌EPS还原作用。电化学活性菌EPS具有电化学性质,其导电物质可通过电化学还原作用参与有机污染物的电子转移。如典型电化学活性菌Shewanella oneidensis MR-1、Bacillus sp. WS-XY1和Pichia stipites的EPS具有电化学活性,具体表现为:
(a)细胞被EPS覆盖时,直接胞外电子转移(Extracellular electron transfer,EET)减弱;
(b)EPS中储存的电化学活性物质(黄素和细胞色素c)可作为电子转移介质维持细胞与电子供体/受体间隙中高浓度电子穿梭,因此间接EET电子传递加强;
(c)当EPS被提取后,会导致细胞表面蛋白失活而失去EET作用。Mtr呼吸通路是有机污染物胞外生物转化的主要电子传递途径,如希瓦氏菌MR-1可通过细胞色素c(MtrC/OmcA)直接还原或通过胞外电子介体(黄素)间接还原对萘酚绿染料脱色;腐殖酸HS除了可作为电子转移瞬时介质,也可作为直接电子供体,参与偶氮染料、卤代物、硝基芳香族化合物等污染物的还原过程,因此增加HS含量会增加电化学反应途径,促进苯并芘利用度和降解速率;腐黑质可同时充当电子受体和电子供体,参与微生物还原五氯苯酚脱卤过程和胞外电子转移过程。
(2)非电化学活性菌EPS还原作用。非电化学活性的微生物在没有外源电子供体的情况下,可利用EPS中还原性成分通过胞外电子转移机制还原高氧化态污染物(如NAC、铬酸盐和高氯酸盐)。
Fuxing Kang等发现,多种纯培养微生物(大肠杆菌、黄孢原毛平革菌、酿酒酵母)和天然生物膜中提取的EPS能将1,3-二硝基苯(1,3-DNB)还原为3-羟氨基硝基苯和3-硝基苯胺。光谱分析1,3-二硝基苯反应前后的EPS,结合Tollen检验表明,EPS中鼠李糖的半缩醛基、脂多糖的不饱和脂肪链和酚基可作为还原剂,醌部分起电子穿梭作用。Xinwei Zhou等在研究非电活性细菌EPS还原NAC机制时发现,无外源电子供体时细菌消耗EPS中还原糖的半缩醛基团(主要电子供体)以产生电子,电子通过电子转移介质(黄素和醌)传递到细胞外细胞色素,再传递到细胞内氧化还原活性蛋白还原NAC。
3.3EPS与有机污染物之间的生物作用(酶生物降解)
EPS中胞外酶主要包括胞外水解酶和氧化还原酶,其活性可影响有机污染物(染料、多环芳烃、多氯联苯、有机磷类等)降解速率。
(1)胞外水解酶:主要包括碳水化合物水解酶(如淀粉酶、纤维素酶)、蛋白水解酶、酯酶、磷酸酶、植酸酶、脂肪酶等,可水解糖基、酰胺和酯官能团。如活性污泥EPS中提取的酶可催化水解β-酰胺和达普霉素;类产碱假单胞菌的角质酶(PpCutA)和海洋假单胞菌的酯酶(PpelaLip)可水解各种不同结构聚酯类污染物。
(2)胞外氧化还原酶:主要包括非特异性过氧化物酶,如P450、漆酶、过氧化氢酶、木质素过氧化物酶(LiP)、锰过氧化物酶(MnP)等。真菌产生的非特异性过氧化酶(P450单加氧酶、血红素过氧化物酶)的催化活性与胞内单加氧酶功能相近,可氧化大部分EPA优先有机污染物。
Chunyun Jia等将菌胶团(Zoogloea sp.)提取的EPS用于降解土壤中芘,结果表明EPS中检测出的漆酶、多酚氧化酶、过氧化氢酶〔活性分别为(0.41±0.04)U/L、(59.67±3.51)U/L、(55.05±1.13)U/L在芘降解中起着重要的作用。姜春阳发现加入EPS后,分支杆菌对芘和苯并[a]芘降解率分别提升了9%和6%,毛霉菌对芘、苯并[a]芘的降解率分别提升了9%和5%,蛋白质谱发现EPS中存在PAHs关键降解酶。真菌可释放胞外漆酶(活性达90~100 U/L)分解染料,不同染料分解机制不同,如漆酶可直接氧化蒽醌,而漆酶与偶氮和靛蓝相互作用受小分子代谢物调节。木腐真菌胞外LiP可降解大于90%的酚类污染物。
EPS与有机物之间的物理、化学和生物作用各自贡献比例报道较少。已有研究发现粘着剑菌En-sifer adhaeren去除多氯联苯(PCB)时,最初生物吸附起主要作用,而随着培养时间延长生物降解作用越来越重要,且生物降解与LB-EPS中多糖和酶活性成正相关。未来是否可采用模式化合物替代EPS中相关作用组分,考察其与污染物降解相关作用关系,并准确构建有机物代谢模型仍有待研究。
04
群体感应调控有机污染物去除机理
群体感应(QS)是细胞间的交流过程,即细菌可通过分泌和感应特定的化学物质(信号分子)并调节基因表达来调控群体密度。QS可以调节生物膜的形成、生物表面活性剂的产生、胞外多糖的合成、水平基因转移、代谢基因表达、运动性和趋化性等相关的基因表达。
4.1调控有机污染物降解基因
许多细菌同时具有QS〔酰基高丝氨酸内酯/自诱导物(AHL/AI)合成酶基因系统和芳烃降解〔芳香环羟化双加氧酶(RHD)基因系统。
如铜绿假单胞菌CGMCC1.860具有rhl QS系统,其产生的HHL(己酰基-L-高丝氨酸内酯)和BHL(丁酰基-L-高丝氨酸内酯)参与调控苯酚降解。进一步研究发现,CGMCC1.860 rhl QS系统正调控nahH〔编码儿茶酚2,3-双加氧酶(C23O)的基因和nahR(转录激活因子),促进邻二苯酚间位裂解途径及芳香烃生物降解。铜绿假单胞菌PAO的LasI-和RhlI-控制3OC12-HSL和C4-HSL产生,其信号受体为LuxR-(LasR、RhlR、QscR),LuxR同源依赖型AHLs(C10-HSL)控制ant操纵子的转录激活子,ant操纵子编码邻氨基苯甲酸盐降解成三羧酸循环中间体的酶,AHLs影响污染物降解和能量代谢。
此外,新鞘氨醇杆菌ERW19含novR1/novI1和novR2/novI2 QS系统,其依赖这两个QS系统激活微囊藻毒素(MC)降解基因(mlrA)转录从而正调控MC降解。
4.2调控EPS成分促进有机物降解
群体感应信号分子通过调控EPS产生间接促进有机污染物降解(见表 2),即信号分子调控EPS的组分(胞外蛋白、胞外多糖、鼠李糖脂等)变化促进污染物降解。
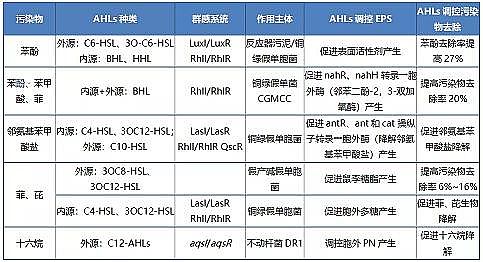
表 2 调控有机污染物去除和EPS合成的AHLs基因情况
(1)促进生物膜形成和PS/PN合成。与悬浮细胞相比,生物膜中的微生物可抵抗外界有毒化学环境、pH波动等的不利影响,共享群体感应和代谢产物,因此加速了有机物降解。
Xi Tang等运用代谢组学发现厌氧氨氧化中AHLs主要通过增加Ala(丙氨酸)、Val(缬氨酸)、Glu(谷氨酸)、Asp(天冬氨酸)和Leu(亮氨酸)等氨基酸含量来促进细胞外蛋白的生成,从而促进生物膜/EPS的合成以强化十六烷、硝基苯、甲苯等有机物的去除。Yue Gu等向乳酸菌(Lactobacillus plantarum)中添加不同浓度的AI-2促进了EPS产生。这是因为lamC(编码多糖水解酶基因)编码的蛋白质可水解各种多糖,对β-(1,3)-和β-(1,6)-连接的葡聚糖底物表现出酶活性,而对β-(1,4)-连接的葡聚糖和木聚糖底物表现出内生酶活性,ftsH(编码膜蛋白降解酶基因)相关的FtsH蛋白普遍存在于膜上,可降解膜蛋白;AI-2可抑制lamC和ftsH的基因表达以促进EPS产生与生物膜的形成。
(2)促进蛋白酶表达。水解酶在水解复杂有机质和营养物矿化方面起重要作用,如Pantoea ana-natis B9产生的6种AHLs(C4-HSL、3OC6-HSL、C6-HSL、C10-HSL、C12-HSL和C14-HSL)均可增强胞外水解酶(碱性磷酸酶)的活性;菊欧文氏菌(Erwinia chrysanthemi)具有ExpI/ExpR群感系统,其产生的3OC6-HSL可控制蛋白酶合成;嗜水气单胞菌具有AhyI/AhyR系统,其产生的C4-HSL可控制丝氨酸蛋白酶和金属蛋白酶生产。
(3)促进表面活性剂合成。表面活性剂是促进细菌吸附、吸收和跨膜运输有机物的关键物质,而AHLs可通过影响细胞表面活性、疏水性和乳化活性提高生物吸附和降解性能。如铜绿假单胞菌可通过产生胞外鼠李糖脂(糖脂)增加疏水性化合物的利用率,强化制药、食品、油污等行业的生物修复。
当外源C4-HSL存在时,铜绿假单胞菌N6P6细胞表面疏水性为51.33%(无AHLs的空白组比例为35.33%),菲的降解率提升到93.3%(而空白组仅为85.6%)。铜绿假单胞菌调节该鼠李糖脂合成的主要QS系统是las、rhl和pqs系统,具体调控过程为:首先,RhlI合成酶产生信号分子C4-HSL;之后,C4-HSL与RhlR结合,激活rhlAB(鼠李糖脂合成酶)基因转录,从而在细菌稳定生长阶段启动鼠李糖脂的生物合成。
此外,QS调节有机物降解过程和机理具有菌种特异性和复杂性。如群体感应菌Novosphingobium pentaromativorans US6-1具有novI/novR-QS系统,novI/novR突变后,大多数PAH降解酶(初始酶RHD、4-羟基苯甲酸酯-3-单加氧酶和水杨醛脱氢酶)基因丰度上调,但EPS产量下调,菲去除率上升。
总体来讲,AHLs调控EPS产生促进污染物降解的作用机理仍不完善,目前仅限于了解AHLs是通过促进鼠李糖脂、胞外酶的产生而促进了污染物降解,但EPS其他组分是否及如何参与污染物生物降解仍不清晰。未来有待采用分子生物学技术(基因组学、蛋白组学、糖组学、代谢组学)进一步揭示EPS的具体组分(氨基酸、单糖)及其功能,为废水生物处理中AHL调控有机污染物降解提供理论指导。
4.3调控微生物运动与趋化
QS可调节细菌运动性,此功能为降解污染物或利用细菌进行生物修复提供了更快的方法。如rhlI可调节铜绿假单胞菌的集群运动,QS基因qsmR可调控Burkholderia glumae鞭毛方向基因的表达,E. coli K-12表现出趋向AI-2的趋化运动。张祥武在研究大肠杆菌密度感应调节子C(Quorum sen-sing E.coli regulator C,QseC)在生物材料植入感染中的作用时发现,大肠杆菌QseC可以通过调控细菌的运动性调节细菌生物膜形成。当细胞感觉到载体表面,QS基因rhl开始表达调控产生EPS和表面活性剂,以促进PAH溶解和进入细胞,并通过鞭毛控制微生物趋化,形成生物膜和加速PAH降解。
4.4调控微生物水平基因转移
细菌群落间经常发生水平基因转移(HGT)或细菌间遗传物质横向转移,而群体感应可通过两种方式HGT调控有机物降解:
(1)当质粒和转座子上携带编码降解外源污染物的分解代谢基因时,细胞通过QS调控DNA释放和转化以强化污染物降解。QS基因rhl对生物膜中基因转移起重要作用,rhlR负责胞外DNA释放,并和comX相互作用,comX则负责细胞对细胞外DNA的吸收和转化。
(2)AHLs位于可移动遗传元件(Mobile genetic elements,MGE),如质粒、细胞外DNA、噬菌体等。其相关基因本身可在不同细菌间转移、交流,加速HGT,增强生物膜群落中的生物降解,生物膜中细胞质粒染色体转化效率比游离态细胞的转化率高10~600倍。
4.5调控优化微生物生长及群落结构
4.5.1 纯菌体系
纯菌体系中QS系统受控于外界环境条件、外源有机物或其中间代谢产物,对污染物降解基因表达进行正调控或负调控。外源有机污染物胁迫时,细胞生存最大化策略优先于代谢策略,具体调控方式为:
(1)能量代谢调控。铜绿假单胞菌具有降解多种有机化合物(如联苯、原油和多环芳烃)的能力,其具有lasI/lasR和rhlI/rhlR群感系统,其中,依赖Rhl的QS可控制许多芳香烃的分解代谢基因表达。
在铜绿假单胞菌中,色氨酸降解过程中生成邻氨基苯甲酸,其可通过喹诺酮(PQS)生物合成途径直接激活假单胞菌喹诺酮信号,或通过ant-cat途径转移至能量产生。另据报道,氧化应激诱导剂百草枯(农药、有机污染物)暴露下,大肠杆菌可增加还原型辅酶Ⅱ(NADPH)产量,同时减少还原型辅酶Ⅰ(NADH)的产生。
(2)下调代谢基因转录。群感菌RshUS6-1的rsh基因虽然负调控多环芳烃降解相关的基因表达,但可促进细菌适应环境压力和提升其生存能力,因此间接提高细菌降解多环芳烃的效率。
(3)猝灭信号分子。分解代谢途径的某些酶或中间代谢物表现为群体猝灭剂,可猝灭信号分子及抑制群体感应。如芳烃降解过程中,Hod环裂解酶可以裂解PQS。
(4)全局调控。如BkdR为支链酮酸脱氢酶的转录激活剂,控制碳水化合物分解代谢酶,影响绿脓素合成,调节喹诺酮信号(PQS)QS系统,通过自溶作用释放细胞外DNA,芳香化合物胁迫下,全局调节子crc可通过BkdR抑制细胞内碳水化合物分解。
4.5.2 复杂群落体系
复杂系统中往往涉及细胞间的相互作用。由于微生物群落结构和功能对AHLs很敏感,可以通过调控QS优化群落结构,共享新陈代谢途径和优化能量产生和消耗,促进外源有机污染物的生物降解和矿化。
极少数情况下,单一细菌在外界环境压力下可以进化获得降解污染物的所有代谢途径,如假单胞菌Pseudomonas ADP持有降解阿特拉津的所有基因。
混合种群中,QS可以使某个种群对其他种群更有优势,即与带有竞争关系和防御机制的细菌共存时,有QS的细菌可以使竞争性细菌停止或者缓慢生长。
如向好氧颗粒污泥中外源添加由多种QS纯菌中提取的AHLs混合液可诱导更多AHLs释放,促进气单胞菌属(Aeromonas)和假单胞菌属(Pseudomonas)富集,提高污染物去除效果。
A. Valle等通过向活性污泥中外源添加AHLs(3O-C6-HSL和C6-HSL)加速了苯酚降解,且研究表明索氏菌属(Thauera)的优势功能(苯酚组)被卡玛单胞菌属(Comomonas)(苯酚+AHLs组)取代,即AHLs介导了微生物群落变化。
未来如何寻找或组装更快矿化外源有机物的群体感应菌株组合,防止有毒中间产物的积累需要进一步研究。
05
展望
随着现代组学等分析手段的应用,有机污染物胞外降解及调控机理研究得到进一步拓展。但由于EPS组成成分和空间结构复杂,且含有不可溶解物质,未来EPS分析方法及其生理学功能仍有待完善。
此外,有机物降解过程中的化学趋化、转录调控和群体感应调控机理仍有待深入研究。未来研究趋势总结如下:
(1)识别EPS与有机污染物作用的关键组分,通过控制外界因素或生物作用来调节此类关键组分,提升EPS去除有机物的效率;采用模式化合物模拟EPS成分,构建有机物代谢模型,并采用真实的废水处理系统验证其有效性。
(2)关注QS对微生物去除污染物的调控机理,采用基因组学、转录组学、代谢组学等发掘QS调控EPS合成的基因及具体组分,同时结合光谱技术检测调控后EPS与污染物之间的作用基团的变化,为精准QS调控废水生物处理中有机污染物降解提供有效途径。
(3)研究复杂系统中应用QS调控污染物降解的群落构建机理。复杂系统中群落组成的变化和质粒的水平转移,QS菌、QQ菌和不产生不响应信号分子的菌互相交流,致使其污染物去除机制更复杂,如何寻找或组装更快矿化外源有机物的群体感应菌株组合,防止有毒中间产物的积累仍有待进一步研究,其将对实际废水处理中有机物的去除具有重要意义。
纤维束填料1米生产厂家详情点击:http://www.lvliaochangjia.com/